Digitale Medizinprodukte - Zulassung leicht gemacht
Das wichtigste Nachweisdokument für die Gebrauchstauglichkeit von Medizinprodukten ist die Gebrauchstauglichkeitsakte. Sie umfasst alle Nachweise, die aus regulatorischer Sicht (IEC 62366 und MDR) im Hinblick auf die Zertifizierung eures Medizinproduktes oder eurer digitalen Gesundheitsanwendung (DiGA) notwendig sind. Wir haben Euch alle Anforderungen in einem Poster zusammengestellt.
Poster herunterladenUnser Ziel ist die gemeinsame Entwicklung von erstklassigen Medizinprodukten und digitalen Gesundheitsanwendungen (DiGA) mit einem multidisziplinären Team aus Healthcare-Experten und Entwicklern, die umfassendes Branchenwissen und tiefe Einblicke in regulatorische Anforderungen bieten. Wir liefern euch einen maßgeschneiderten Service, der von der Anforderungsanalyse über Usability Engineering nach IEC 62366 bis hin zur Entwicklung reicht. Als IT-Dienstleister im Gesundheitswesen konzentrieren wir uns auf Design und Entwicklung, basierend auf echten Nutzungsanforderungen.
Unser Ansatz sichert nicht nur die regulatorische Konformität eures Medizinproduktes, sondern fördert auch eine optimale Nutzererfahrung und damit euren Markterfolg.
Unser Ansatz sichert nicht nur die regulatorische Konformität eures Medizinproduktes, sondern fördert auch eine optimale Nutzererfahrung und damit euren Markterfolg.

Warum wir?
Wir begleiten euch norm-konform und leichtgewichtig auf eurem Weg an den Medizinprodukte-Markt. Dabei bieten wir genau den für euch passenden Service entlang des gesamten Entwicklungsprozesses an: Vom Anforderungsmanagement über die fertige Gebrauchstauglichkeitsakte und der Entwicklung!
Wir sind euer Partner

Wir unterstützen Euch da, wo ihr konkret Hilfe benötigt. Ob UX-Design, Usability Testing oder die Erstellung von zulassungsrelevanten Reports - wählt die auf eure Bedürfnisse abgestimmten Services.
Vertraut auf unser erfahrenes, multidisziplinäres Team von UX-Expert*innen, UI-Designer*innen, Qualitätsmanager*innen, Branchenexpert*innen und Entwickler*innen.
Nutzt unsere langjährige Erfahrung in der Inverkehrbringung von Software als Medizinprodukt sowie von Digitalen Gesundheitsanwendungen (DiGAs).
Als IT-Dienstleister sprechen wir eure Sprache. Wir verstehen Euch, wenn ihr von Client Architekturen, Frameworks und SCSS sprecht und kennen die Herausforderungen in der Umsetzung von Design in Code.
Ihr könnt von unserem breiten Know-how im Service Design im klinischen Kontext - sowohl im B2B als auch im B2C Bereich - profitieren.
Als große AG sind wir stark vernetzt und stehen in engem Austausch mit Ärzt*innen und Fachgesellschaften wie Hausärzten, Kardiologen und Nephrologen sowie Patient*innen.
Das sagen unsere Kunden
AKQUINET hat uns sehr kompetent und umfassend zum Thema Usability Engineering für das Produkt Implays beraten.
Die UX-Spezialisten von AKQUINET haben bereits während des Designs unser Angebot speziell auf die Bedürfnisse
der Sportler und Trainer abgestimmt und es gleichzeitig geschafft komplexe Abläufe im Sport für unsere Anwender sehr verständlich und anschaulich aufzubereiten.

Max Schoeppe
COO Black Tusk GmbH
Unsere Services
Digitale Gesundheitsanwendungen (DiGAs) und Medizinprodukte gemeinsam auf den Weg bringen.
Requirements Engineering
Bei der Spezifikation eurer (technischen) Anforderungen gibt es hinsichtlich Nachvollziehbarkeit und Prüfbarkeit einiges zu beachten.
Wir helfen euch dabei, am Anfang alles richtig zu machen, um bis zum fertigen Produkt Zeit und Geld zu sparen!
Usability Testing nach IEC 62366
Formative und summative Evaluation sind ein Muss für eure Medizinprodukte - wir testen eure Prototypen genauso wie euer fertiges Produkt.
Dazu steht uns eine enorme Bandbreite an Testmethoden und Equipment zur Verfügung sowie bewährte Templates und Reviews für eure Reports.
Risikomanagement nach ISO 14971
Wir zeigen euch, wie ihr norm-konform Risiken identifiziert, welche Möglichkeiten ihr zur Risikominderung habt und wie ihr die Risiken überprüfen könnt.
Prototyping & Human-Centered Design
Unser erfahrenes Designteam entwickelt euer User Interface - von den ersten Entwürfen
bis hin zu fertigen Oberflächen - iterativ und nutzerzentriert im ständigen Abgleich mit den Anforderungen.
Dokumentation & Reports
Welche Inhalte müssen in die Gebrauchstauglichkeitsakte?
Wie werden die Inhalte am besten aufgebaut und worauf muss bei der Dokumentation geachtet werden? Bei diesen und anderen Fragen könnt ihr auf uns zählen!
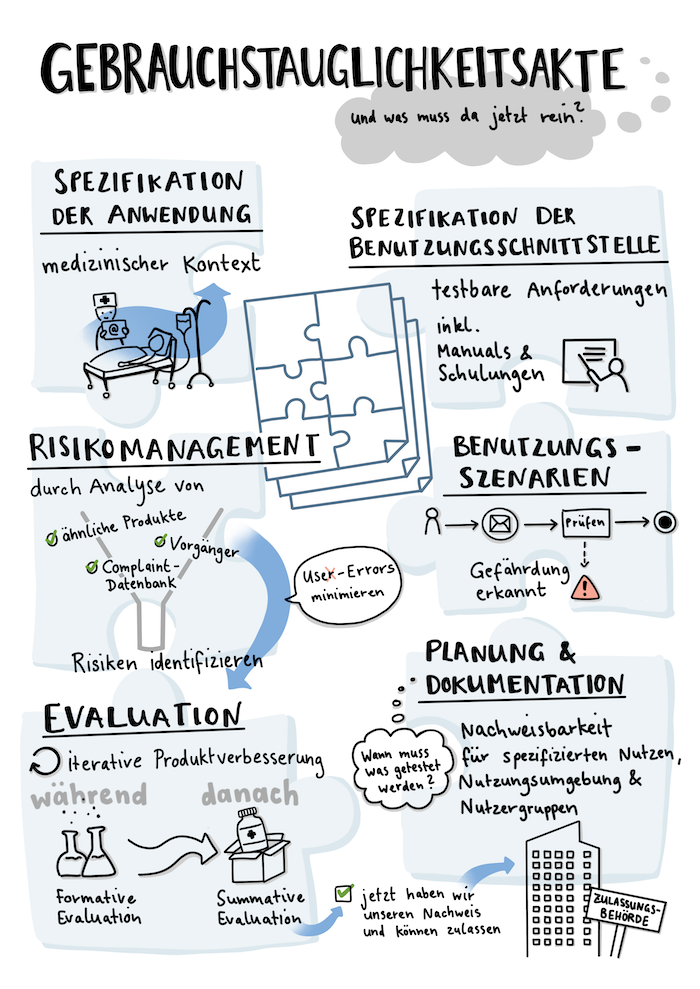
Die Gebrauchstauglichkeitsakte nach IEC 62366 und MDR
Die Gebrauchstauglichkeitsakte umfasst alle Dokumente, mit denen ihr die gesetzlichen Anforderungen an die Gebrauchstauglichkeit eures Medizinprodukts oder eurer DiGA nachweisen müsst.
Hier könnt ihr nachlesen, wie wir euch zur Gebrauchstauglichkeitsakte unterstützen.- Was gehört denn alles in die Gebrauchstauglichkeitsakte?
- Wann starte ich welche Aktivität, um die Akte zu füllen?
- Wen muss ich involvieren und wie genau soll ich dokumentieren?
- Wann muss die Akte fertig sein?
Entwicklungspartnerschaft
Als euer Entwicklungspartner begleiten wir euch bei der Realisierung digitaler Medizinprodukte, stets im Einklang mit den neuesten Normen und Standards, insbesondere der IEC 62366 und IEC 62304. Unser Ziel ist es, durch unsere Fachkenntnis und Erfahrung in diesen regulatorischen Bereichen, den Entwicklungsprozess nicht nur zu vereinfachen, sondern auch sicherzustellen, dass eure Produkte den höchsten Qualitäts- und Sicherheitsanforderungen entsprechen. Wir sind hier, um euch durch den gesamten Prozess zu begleiten.
DiGA-Framework
Als euer Entwicklungspartner stehen wir mit unserem innovativen DiGA-Framework bereit, um euren Entwicklungsprozess signifikant zu beschleunigen. Unser Ansatz ermöglicht einen sofortigen Einsatz, wodurch ihr von Anfang an Zeit und Ressourcen spart. Doch Flexibilität steht bei uns ebenso im Fokus: Unser Framework ist darauf ausgelegt, maßgeschneidert an eure spezifischen Bedürfnisse angepasst zu werden. So kombinieren wir Geschwindigkeit mit individueller Anpassungsfähigkeit, um euren Projekterfolg zu maximieren.
Auf unserem Blog weiterlesen
Risikomanagement bei Medizinprodukten
In einer Ära, in der digitale Technologien das Rückgrat des Gesundheitswesens bilden, spielt die Klassifizierung von Software als Medizinprodukt eine entscheidende Rolle für die Patientensicherheit und Effektivität des Produkts. Unser Artikel beleuchtet die Risiko- und Sicherheitsbewertung medizinischer Software innerhalb der europäischen Medizinprodukte-Verordnung (MDR) und der spezifisch darauf ausgerichteten IEC 62304.
Usability Engineering für Medizinprodukte nach IEC 62366
Die Usability von Medizinprodukten ist entscheidend, um die Sicherheit der Patient*innen zu gewährleisten. Die Norm IEC 62366-1 legt Anforderungen an die Produktentwicklung fest, einschließlich der Identifikation der Nutzer, iterativer Produktentwicklung und summative Evaluation. AKQUINET berät Unternehmen, um Normerfüllung und Effizienz zu optimieren.
Eure Ansprechpartner
Oder schreibt uns eine Nachricht über unser Kontaktformular
Kontaktformular öffnen

